Il microbiota intestinale: aspetti e funzioni fra uomo e animale. Infiammazione, invecchiamento, comportamento
L’infiammazione accompagna molti percorsi patologici. Si affianca e, in modo subdolo convive, con i disordini dell’umore, con patologie cardiache, renali, epatiche, intestinali, e con altro ancora. Non sarebbe stato possibile conoscere tanti dettagli sul processo infiammatorio se non avessimo avuto la preziosa collaborazione di animali domestici come cani e gatti

Introduzione
Se pensiamo all’infiammazione, sembra che non si possa pensare a un’infiammazione per l’animale e a una per l’uomo, verosimilmente i meccanismi saranno gli stessi, almeno quando parliamo di mammiferi, ed è sicuramente vero che non sarebbe stato possibile conoscere tanti dettagli sul processo infiammatorio se non avessimo avuto la preziosa collaborazione degli animali.
L’infiammazione accompagna molti percorsi patologici, si affianca e, in modo subdolo (infiammazione silente) convive con i disordini dell’umore, con le patologie cardiache, con quelle renali, con quelle epatiche ecc. e con quelle intestinali, da cui, nella maggior parte dei casi partono gli insulti che declinano molte delle malattie che colpiscono l’uomo e l’animale. Per queste ragioni, questo scritto, riguarderà prevalentemente le dinamiche del rapporto Microbiota/Infiammazione nel mondo degli animali da compagnia.
Nel controllo mirato del processo infiammatorio a partire dal Microbiota Intestinale, sta, verosimilmente, la possibilità di controllare le più comuni patologie che affliggono i nostri piccoli amici e di affiancare presidi terapeutici innocui a quelli classici e, molte volte, di potere evitare che l’uso prolungato dei classici determini spiacevoli effetti collaterali.
Il Microbiota intestinale presenta aspetti di similitudine fra le varie specie dei mammiferi e mantiene tale caratteristica di stabilità relativa che può risentire dei fattori genetici e ambientali dell’ospite (Gaskins HR, Croix JA, Nakamura N, Nava GM: Impact of the intestinal microbiota on the development of mucosal defence. Clin Infect Dis 2008; 46: S80–S86).
Una relazione equilibrata tra ospite e Microbiota Intestinale è essenziale per garantire una risposta immunitaria adeguata e per la corretta discriminazione tra patogeni e specie simbiotiche di microbi enterici. Una rottura di questo equilibrio può favorire l’alterazione della composizione microbica, “disbiosi”, e produrre quella condizione che apre la porta al passaggio di sostanze inducenti il processo infiammatorio, favorendo in tal modo l’insorgere di complicanze patologiche e patologie a distanza con importanti conseguenze cliniche (Neish A: Microbes in gastrointestinal health and disease. Gastroenterology 2009; 136: 65– 80).
Barriera intestinale
L’integrità della barriera della mucosa intestinale è garantita dalla presenza dei batteri commensali.
Essi competono con i patogeni nei siti di captazione dell’orletto a spazzola e competono anche per la disponibilità di nutrienti, evitando così la sovraesposizione di potenziali agenti patogeni. Il Microbiota, inoltre, è in grado di produrre sostanze antibatteriche, come le batteriocine (Massimo Cocchi e Matteo Pialorsi. Dai Batteri Sicuri alle Batteriocine Utili, Quaderni della Biologia Sperimentale, Sezione di Bologna). Contribuisce anche al mantenimento dell’integrità della barriera mucosa attraverso il miglioramento dell’espressione delle tight junctions e la promozione della riparazione epiteliale a seguito del danno (Chung H, Kasper DL: Microbiota-stimulated immune mechanisms to maintain gut homeostasis. Curr Opin Immunol 2010; 22: 455–460).
La perdita dell’integrità della barriera intestinale comporta una condizione di disbiosi con conseguente aumento della traslocazione batterica attraverso la parete intestinale. A seguire si determina sia un’iperattivazione del sistema immunitario sia un aumento, ad es., di lipopolisaccaridi circolanti con endotossiemia (Sekirov I, Russel SL, Antunes CM, Finlay BB: Gut microbiota in health and disease. Physiol Rev 2010; 90: 859–904).
Il prolungarsi di questo processo modifica la tolleranza immunitaria e instaura uno stato di risposta infiammatoria cronica (Fava F, Danese S: Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol 2011; 17: 557–566).
Infiammazione
L’infiammazione è una reazione di difesa dell’organismo contro l’induzione di lesioni. Tradizionalmente l’infiammazione è caratterizzata da arrossamento, gonfiore, dolore, calore e alterazioni di funzioni dell’organismo. Il rossore e il calore sono causati da un aumento del flusso sanguigno, il gonfiore dall’accumulo di liquidi e il dolore dal gonfiore, ma anche da rilascio di composti che danno origine a segnali nervosi. Il deterioramento delle funzioni riconosce ragioni diverse. L’infiammazione è un fenomeno che serve per eliminare gli agenti nocivi e preparare il terreno per la guarigione.
L’infiammazione può essere attivata da fattori interni ed esterni. Potenti induttori dell’infiammazione sono la presenza di microrganismi nei siti di non appartenenza. Le cellule e le molecole coinvolte nel sistema di difesa infiammatoria reagiscono immediatamente contro gli elementi estranei a quelli degli organismi animali, quali quelli dei batteri e dei funghi (es.: parete cellulare) e dei virus (es.: RNA e DNA); inoltre, lesioni al tessuto e alle cellule dell’organismo provocano infiammazione. Quando le cellule del corpo sono danneggiate, sostanze, normalmente nascoste all’interno delle cellule, vengono rilasciate e funzionano come segnali di pericolo endogeno. Tutte le tipologie delle reazioni immunitarie porteranno all’attivazione del sistema di difesa anti-infiammatoria.
Il processo infiammatorio parte da cellule già presenti nel tessuto, ad esempio macrofagi residenti, cellule dendritiche e Mast Cells (MCS). I segnali di pericolo attivano queste cellule e vengono rilasciati i mediatori infiammatori, che iniziano il processo responsabile dei segni clinici dell’infiammazione.
Il processo di infiammazione coinvolge quattro fasi:
- I vasi sanguigni si allargano, con conseguente aumento del flusso sanguigno (causando arrossamento e aumento di calore);
- Aumentata la permeabilità dei vasi sanguigni, che si traduce in un deflusso di fluidi e proteine plasmatiche nel tessuto, manifestandosi come gonfiore;
- I globuli bianchi vengono reclutati dalla circolazione del sangue al tessuto;
- Il metabolismo viene regolato, ad esempio, con un aumento dei livelli di glucosio nel sangue e si possono verificare sintomi quali febbre, stanchezza e perdita di appetito.
Nell’infiammazione acuta si verifica un accumulo di granulociti neutrofili nel tessuto infiammato, mentre nell’infiammazione cronica c’è un accumulo di linfociti, macrofagi e cellule plasmatiche nel tessuto e anche fenomeni di infiltrazione tissutale. In una reazione allergica, tuttavia, ci sarà una rapida accumulazione di granulociti eosinofili e linfociti T, e talvolta anche neutrofili. Un esempio rappresentativo di una situazione che porta alla infiammazione acuta è un’infezione batterica, ma anche la morte cellulare, l’infarto del miocardio o la decomposizione di tumori portano all’infiammazione acuta.
Le cause tipiche dell’infiammazione cronica sono infezioni con batteri intracellulari, malattie autoimmuni, allergie di contatto e reazioni contro corpi estranei (Mölne, J.; Wold, A. Inflammation, 1st ed. Liber AB: Stockholm, Sweden, 2007).
L’infiammazione sistemica di basso grado (Infiammazione silente), caratterizzata principalmente da un aumento della CRP (Proteina C Reattiva), è associata ad un aumento del rischio di malattie cardiovascolari (Ridker, P.M. Clinical application of C-reactive protein for cardiovascular disease detection and prevention. Circulation 2003, 107, 363–369) e di obesità; gli individui obesi, infatti, hanno livelli più elevati di CRP rispetto a soggetti di peso normale (Piéroni, L.; Bastard, J.P.; Piton, A.; Khalil, L.; Hainque, B.; Jardel, C. Interpretation of circulating C-reactive protein levels in adults: Body mass index and gender are a must. Diabetes Metab. 2003, 29, 133–138; Visser, M.; Bouter, L.M.; McQuillan, G.M.; Wener, M.H.; Harris, T.B. Elevated C-reactive protein levels in overweight and obese adults. JAMA 1999, 282, 2131–2135).
Infiammazione silente e citochine
Nell’accezione comune, come precedentemente riportato, con il termine infiammazione si intende qualche cosa di percepibile, cioè, il divenire di un processo che, normalmente, si estrinseca, oltre ai classici segni esterni con manifestazione dolorosa.
Non è sempre così, le acquisizioni relative alla scoperta di nuovi mediatori del processo infiammatorio, cioè le citochine, hanno consentito, con la possibilità di dosarle, di individuare una presenza infiammatoria silente in molte gravi patologie.
Il termine “citochine” deriva da una combinazione di due parole greche – “cito” che significa cellulare e “kinos” che significa movimento. Le citochine sono molecole di segnalazione cellulare che aiutano la comunicazione cellula-cellula nelle risposte immunitarie e stimolano il movimento delle cellule verso siti di infiammazione, infezioni e traumi.
Le citochine si classificano in:
1. Citochine anti-infiammatorie: contrastano vari aspetti dell’infiammazione, per esempio, l’attivazione delle cellule o la produzione di citochine pro-infiammatorie, contribuendo così al controllo della entità delle risposte infiammatorie in vivo [Li X et al. IL-35 is a novel responsive anti-inflammatory cytokine: a new system of categorizing anti-inflammatory cytokines. PLoS One. 2012;7(3)]. Quando i tessuti si infiammano, i fattori pro-infiammatori possono stimolare i tessuti per esprimere citochine anti-infiammatorie ”reattive”, e contrastare la risposta infiammatoria.
2. Citochine pro-infiammatorie: un termine generale per quelle citochine immunomodulanti che favoriscono l’infiammazione.
Il termine meta-infiammazione [(Hotamisligil GS. Inflammation and metabolic disorders. Nature 444: 860-867 (2006)] è stato utilizzato per descrivere uno stato fisiopatologico causalmente legato allo sviluppo di infiammazione del tessuto adiposo e alla sindrome metabolica. Questa infiammazione, metabolicamente innescata, si osserva, per esempio, nell’obesità indotta dalla dieta e si caratterizza per l’attivazione di macrofagi pro-infiammatori a scapito di macrofagi anti-infiammatori che, invece, possono proteggere gli adipociti dall’infiammazione in soggetti magri [Lumeng CN et al. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. Journal of Clinical Investigation 117(1): 175-184 (2007); Patsouris D et al. Ablation of CD11c-positive cells normalizes insulin sensitivity in obese insulin resistant animals. Cell Metabolism 8(4): 301-309 (2008)].
Il termine infiammazione sterile, invece, è usato per caratterizzare l’infiammazione che si verifica in assenza di qualsiasi microrganismo (Chen GY and Nuñez G. Sterile inflammation: sensing and reacting to damage. Nature Reviews. Immunology 10(12): 826-837 (2010).
Altri rilevanti siti, oltre alla cellula adiposa (obesità), dove le citochine infiammatorie giocano un ruolo primario sono:
Intestino: il sistema gastroenterico rappresenta un bersaglio di azione delle citochine pro-infiammatorie come risulta evidente nella patogenesi dell’infiammazione intestinale (Pizarro TT, Cominelli F. Cytokine therapy for Crohn’s disease: advances in translational research. Annu Rev Med. 2007; 58:433–444; Olson TS, et al. The primary defect in experimental ileitis originates from a nonhematopoietic source. J Exp Med. 2006; 203(3):541–552; Pagnini C, et al. Probiotics promote gut health through stimulation of epithelial innate immunity. Proc Natl Acad Sci U S A. 2010; 107(1):454–45).
Tessuto adiposo: il sistema immunitario innato e i suoi principali mediatori, le citochine, sono sempre più ritenute di cruciale importanza nell’infiammazione metabolica che è stato osservata nell’obesità morbida e nel diabete di tipo 2.
L’obesità morbida o patologica è normalmente associata all’infiammazione del tessuto adiposo, ed è caratterizzata da un’aumentata espressione di diverse citochine pro infiammatorie come il TNF-alpha, l’interleuchiina-1 e 6 che includono i monociti, i macrofagi, i neutrofili, i linfociti B, T e altri [(Gerner R.R. Wieser V. Moschen A.R. Tilg H. Metabolic inflammation: role of cytokines in the crosstalk between adipose tissue and liver. Canadian Journal of Physiology and Pharmacology, 2013, 91(11): 867-872)].
Malattie cardiovascolari: complesse interazioni cellulari e infiammatorie sono coinvolte nel progresso delle malattie vascolari, quali ad esempio, l’associazione fra citochine pro-infiammatorie con disfunzioni endoteliali e aterosclerosi sembra essere evidente (Kofler S. Nickel T. and Weis M. Role of cytokines in cardiovascular diseases: a focus on endothelial responses to inflammation. Clinical Science (2005) 108: 205–213).
Cervello e comportamento: nuove ricerche hanno portato a importanti progressi nella comprensione di come eventi immuno-correlati nella periferia possono influenzare processi del sistema nervoso centrale, alterando in tal modo la cognizione, l’umore, e il comportamento, e questi progressi stanno suggerendo che infiammazione può avere importanti implicazioni a lungo termine per il cervello (Steven F. Maier, and Linda R. Watkins. Consequences of the Inflamed Brain. Progress 2012).
Va ricordata anche l’importanza di una corretta protezione dell’epitelio intestinale da parte del Microbiota. La via potenziale di accesso al cervello da parte del Microbiota e dei suoi metaboliti si apre attraverso un sistema integrato e complesso di segnali neurali, ormonali e immunologici.
Invecchiamento cani
Sebbene sia stabilito che la composizione del microbiota intestinale umano cambia con l’età, la transizione del microbiota intestinale degli animali con l’età non è stata ben studiata. Una ricerca condotta su campioni fecali freschi ottenuti da cani di 5 diverse fasce d’età (pre-svezzamento, svezzamento, giovani, anziani, senili) ha analizzato le composizioni del loro microbiota intestinale. I risultati hanno suggerito che anche la composizione del microbiota intestinale canino cambia con l’età. Tra i batteri intestinali predominanti nell’intestino del cane, i lattobacilli sembravano cambiare con l’età. Sia il numero che la prevalenza dei lattobacilli tendevano a diminuire con l’avanzare dell’età. I bifidobatteri, invece, non erano predominanti nell’intestino dei cani. Sono state anche identificati i lattobacilli a livello di specie in base alle sequenze del gene 16S rRNA e si è scoperto che anche la composizione delle specie di Lactobacillus cambiava con l’età.
È stato inoltre suggerito che le specie batteriche benefiche per gli animali ospiti possono differire a seconda della specie ospite.
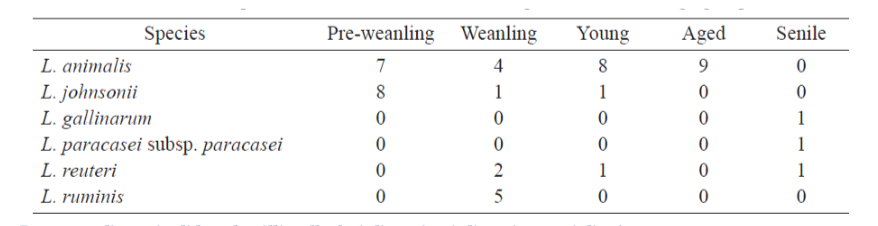
Presenza di specie di lattobacilli nelle feci di cani nei diversi gruppi di età
Risultati della letteratura suggeriscono che le specie Bifidobacterium non sono importanti per la salute dei cani come nel caso degli esseri umani.
Una transizione con l’età si è verificata nei lattobacilli nei cani, suggerendo la possibile importanza di questo gruppo batterico per la salute del cane. Inoltre, a livello di specie, L. animalis e L. johnsonii erano le specie più comuni tra gli isolati dei cani pre-svezzamento, mentre varie specie di Lactobacillus sono state isolate dai cani anziani.
Contrariamente al L. animalis, che è stato isolato da tutti i gruppi di età ad eccezione del gruppo senile, i ceppi di L. johnsonii erano per lo più isolati da cani in pre-svezzamento, suggerendo che il L. johnsonii potrebbe essere una specie specifica per cani neonati ma che il L. animalis può colonizzare cani di tutte le età.
Considerando che alcune delle principali specie probiotiche umane sono specie predominanti nei neonati sani e diminuiscono negli individui più anziani (Maldonado J, Cañabate F, Sempere L, Vela F, Sánchez AR, Narbona E, López-Huertas E, Geerlings A, Valero AD, Olivares M, Lara-Villoslada F. 2012. Human milk probiotic Lactobacillus fermentum CECT5716 reduces the incidence of gastrointestinal and upper respiratory tract infections in infants. J Pediatr Gastroenterol Nutr 54: 55–61; Ménard O, Butel MJ, Gaboriau-Routhiau V, Waligora-Dupriet AJ. 2008. Gnotobiotic mouse immune response induced by Bifidobacterium sp. strains isolated from infants) e che i ceppi di L. johnsonii possono essere utilizzati nello sviluppo di alimenti probiotici (Zielińska D, Rzepkowska A, Radawska A, Zieliński K. 2015. In vitro screening of selected probiotic properties of Lactobacillus strains isolated from traditional fermented cabbage and cucumber. Curr Microbiol 70: 183–194), il L. johnsonii potrebbe essere considerato fra i probiotici specifici per i cani. Inoltre, le specie Lactobacillus nei cani senili sono drasticamente diverse da quelle degli altri gruppi di età.
Il L. gallinarum e L. paracasei subsp. paracasei sono stati isolati solo da cani senili. Tuttavia, poiché questi cani senili studiati erano di varie razze e tenuti in famiglie normali, dovrebbero essere eseguiti ulteriori studi con cani senili in condizioni ben controllate.
Il microbiota intestinale dei cani potrebbe subire cambiamenti dipendenti dall’età a livello sia dei gruppi batterici che delle specie, come nel caso del microbiota intestinale umano, e che i ruoli svolti da alcuni gruppi batterici intestinali di cani potrebbero essere diversi da quelli dell’uomo.
È stato suggerito che i lattobacilli fossero i principali batteri che svolgono un ruolo importante nel controllo delle condizioni intestinali dei cani. I bifidobatteri, che sono uno dei gruppi batterici predominanti negli esseri umani e si ritiene che svolgano un ruolo importante nella salute umana, non erano dominanti nell’intestino del cane, specialmente per i gruppi di età più avanzata. I risultati del presente studio indicano l’importanza dello sviluppo di probiotici specifici per i cani (Hiroaki MASUOKA et al. Transition of the intestinal microbiota of dogs with age. Bioscience of Microbiota, Food and Health Vol. 36 (1), 27–31, 2017).
Invecchiamento gatti
Uno studio, ha analizzato la composizione del microbiota intestinale dei gatti in diverse fasce d’età. Sebbene la stessa coorte di animali non sia stata seguita per anni, i risultati sembrano suggerire aspetti di invecchiamento del microbiota intestinale nei gatti (Masuoka H, Shimada K, Kiyosue-Yasuda T, Kiyosue M, Oishi Y, Kimura S, et al. (2017) Transition of the intestinal microbiota of cats with age. PLoS ONE 12(8): e0181739).
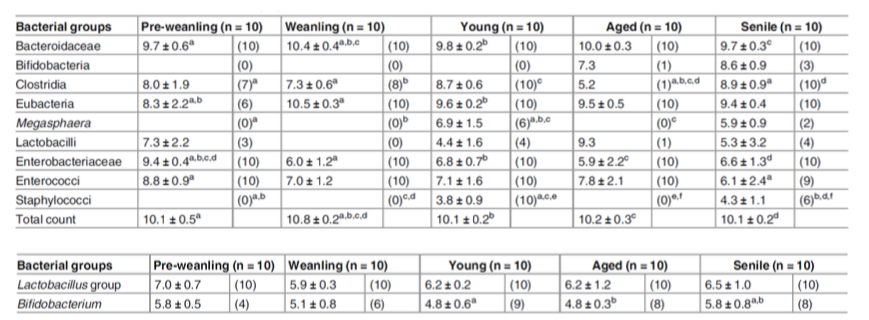
Microbiota fecale delle diverse fasce d’età dei gatti
La relativa abbondanza del gruppo Lactobacillus e Bifidobacterium nei gatti. I lattobacilli e bifidobatteri sono i componenti minori del microbiota intestinale gatto.
Media ± DS di log10/g feci quando l’organismo era presente (numero di soggetti in cui l’organismo è stato rilevato mediante PCR in tempo reale) a, b Le stesse lettere in apice nella stessa linea orizzontale indicano differenze significative (P <0,05).
Sebbene la popolazione di eubatteri risulti inferiore nei gatti in pre-svezzamento rispetto ai gatti svezzati e giovani, Bacteroidaceae ed eubatteri sono predominanti per tutta la vita.
Enterobacteriaceae ed enterococchi erano predominanti nei gattini prima dello svezzamento, mentre il numero di Enterobacteriaceae ed enterococchi sembra diminuire con l’invecchiamento degli animali. I lattobacilli sono stati rilevati da meno della metà degli animali in tutti i gruppi di età e i bifidobatteri sono stati rilevati solo da un gatto anziano e tre senili. Questi risultati sostanzialmente concordano con i risultati ottenuti nei cani secondo cui il tasso di rilevamento dei lattobacilli era basso e che i bifidobatteri erano difficilmente rilevati nei gatti di tutte le fasce d’età (Mitsuoka T, Kaneuchi C. Ecology of the bifidobacteria. Am J Clin Nutr. 1977; 30: 1799±1810).
La ricerca dimostra che il microbiota intestinale dei gatti subisce cambiamenti dipendenti dall’età a livello sia dei gruppi batterici che delle specie, come nel caso del microbiota intestinale umano e del cane. Lo studio riportato suggerisce che i ruoli svolti da alcuni gruppi batterici intestinali di gatti potrebbero essere diversi da quelli degli esseri umani e dei cani. I risultati hanno suggerito che le specie Bifidobacterium e Lactobacillus potrebbero non essere importanti per la salute dei gatti come nel caso degli esseri umani e dei cani. Invece, è stato suggerito che gli enterococchi possano essere uno dei principali batteri produttori di acido lattico che svolge un ruolo importante nel controllo delle condizioni intestinali dei gatti. Il presente studio indica l’importanza dello sviluppo di probiotici specifici per i gatti. Considerando che alcune delle principali specie di probiotici umani sono predominanti nei neonati sani e diminuiscono negli individui più anziani (Mitsuoka T. History and evolution of probiotics. Jpn J Lactic Acid Bact. 2011; 22: 26-37; Maldonado J, Canabate F, Sempere L, Vela F, Sanchez AR, Narbona E. Human milk probiotic Lactobacillus fermentum CECT5716 reduces the incidence of gastrointestinal and upper respiratory tract infections in infants. J Pediatr Gastroenterol Nutr. 2012; 54: 55-61; Menard O, Butel MJ, Gaboriau-Routhiau V, Waligora-Dupriet AJ. Gnotobiotic mouse immune response induced by Bifidobacterium sp. strains isolated from infants. Appl Environ Microbiol. 2008; 74: 660-666), dovrebbero essere eseguiti ulteriori studi sui cambiamenti legati all’età degli enterococchi a livello di specie. È noto che i cambiamenti associati all’età, come la ridotta funzione digestiva e la stitichezza, si verificano spesso nei gatti senili e questi sintomi possono anche essere correlati al microbiota intestinale nei gatti (Barrette D. Alimentation du chien et du chat ages. Can Vet J. 1992; 33: 349–350). Si prevede che specie batteriche, come probiotici, specifiche dei gatti, giocheranno un ruolo importante nella riduzione di questi sintomi (Masuoka H, Shimada K, Kiyosue-Yasuda T, Kiyosue M, Oishi Y, Kimura S, et al. (2017) Transition of the intestinal microbiota of cats with age. PLoS ONE 12(8): e0181739.).
Comportamento
La coscienza è il più grande enigma della storia umana. Per secoli scienziati e ricercatori hanno cercato di descriverlo senza arrivare a conclusioni. Negli ultimi anni con lo sviluppo delle neuroscienze, la coscienza è diventata l’obiettivo comune di numerosi studi. La coscienza è sempre stata studiata solo negli esseri umani, ma dopo la “Dichiarazione di Cambridge sulla Coscienza” del 2012 e il documento di Trapani sulla coscienza animale (Massimo Cocchi, G. Bernroider, Mark Rasenick, Lucio Tonello, Fabio Gabrielli and Jack A. Tuszynski. Document of Trapani on animal consciousness and quantum brain function: A hypothesis. Journal of Integrative Neuroscience -1 (2017) 1–5), anche per gli animali non umani si conferma lo stato di coscienza.
L’ansia e l’aggressività sono problemi comuni nei cani. In effetti, si stima che fino al 70% dei problemi comportamentali nei cani possa essere attribuito a qualche forma di ansia, secondo il Journal of Veterinary Behaviour. Per quanto strano possa sembrare, i batteri che vivono nell’intestino del cane possono influenzare il suo umore e quindi il suo comportamento. Le prove suggeriscono che l’intestino influenza il cervello e questi due comunicano costantemente tra loro.
La somiglianza strutturale e funzionale del microbioma del cane con quello umano implica che, poiché gli studi sull’uomo sono predittivi dei risultati nei cani, gli studi sui cani possono essere predittivi dei risultati nell’uomo. Pertanto, gli studi sui cani forniscono un doppio vantaggio: per i cani direttamente e per il loro potenziale di generalizzazione agli esseri umani (Luis Pedro Coelho, Jens Roat Kultima, Paul Igor Costea, Coralie Fournier, Yuanlong Pan, Gail Czarnecki-Maulden, Matthew Robert Hayward, Sofia K. Forslund, Thomas Sebastian Benedikt Schmidt, Patrick Descombes, Janet R. Jackson, Qinghong Li and Peer Bork. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome (2018) 6:72).
I risultati di una recente ricerca dimostrano che il microbiota intestinale del pastore tedesco ha una composizione diversa rispetto ad altre razze canine e il suo microbiota è simile a quello degli esseri umani depressi. Un’analisi comparativa sul microbiota intestinale del pastore tedesco e degli esseri umani affetti da depressione ha mostrato una stretta somiglianza nella composizione batterica che ha portato a parlare di geografia batterica. Inoltre, lo studio conferma l’unione molecolare tra il pastore tedesco e gli esseri umani che soffrono di depressione. Indagini future sull’interazione tra il microbiota intestinale e l’asse cerebrale negli animali e nell’uomo chiariranno qualsiasi dubbio su questa comunicazione bidirezionale (Elisabetta Mondo, Alessandra De Cesare, Gerardo Manfreda, Claudia Sala, Giuseppe Cascio, Pier Attilio Accorsi, Giovanna Marliani and Massimo Cocchi. Depression and Microbiome—Study on the Relation and Contiguity between Dogs and Humans. Appl. Sci. 2020, 10, 573).
Un’ulteriore prova sul comportamento animale è stata recentemente ottenuta con uno studio relativo alla struttura del microbioma e dell’attività adrenocorticale in cani con comportamento aggressivo e fobico (E. Mondo, M. Barone, M. Soverini, F. D’Amico, M. Cocchi, C. Petrulli, M. Mattioli, G. Marliani, M. Candela, P.A. Accorsi. Gut microbiome structure and adrenocortical activity in dogs with aggressive and phobic behavioral disorders. Heliyon 6 (2020) e03311).
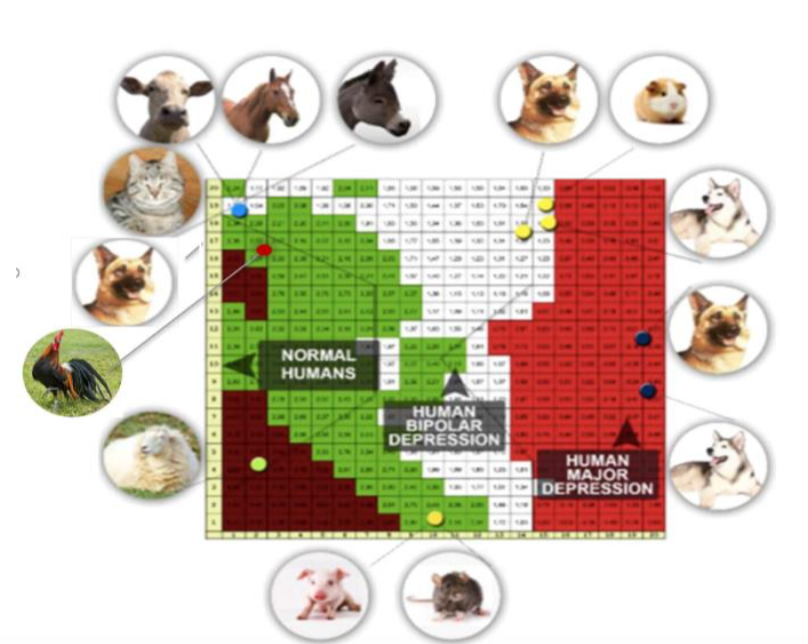
I pastori tedeschi e gli Alaskan malamute si collocano nelle aree della SOM per il disturbo bipolare e per la depressione umana (Cocchi M, Tonello L, De Lucia A, Amato P (2009) Platelet and Brain Fatty Acids: a model for the classification of the animals? Part 1. International Journal of Anthropology 24: 69-76. 10; Cocchi M, Tonello L, De Lucia A, Amato P (2009) Platelet and Brain Fatty acid transfer: Hypothesis on Arachidonic Acid and its relationship to Major Depression. Part 2. International Journal of Anthropology 24: 201-220; Benedetti, S., Bucciarelli, S., Canestrari, F., Catalani, S., Mandolini, S., Marconi, V., Mastrogiacomo, A., Silvestri, R., Tagliamonte, M., Venanzini, R., Caramia, G., Gabrielli, F., Tonello, L. and Cocchi, M. (2014) Platelet’s Fatty Acids and Differential Diagnosis of Major Depression and Bipolar Disorder through the Use of an Unsupervised Competitive-Learning Network Algorithm (SOM). Open Journal of Depression, 3, 52-73).
L’aggressività è un grave disturbo comportamentale nei cani domestici che mette in pericolo sia i cani che gli esseri umani. Le cause alla base dell’aggressività canina sono scarsamente risolte e richiedono illuminazione per garantire una terapia efficace. Ricerche recenti collegano la diversità di composizione del microbioma intestinale alla regolazione comportamentale e psicologica in altri mammiferi, come i topi e gli esseri umani. Sembra confermarsi, vieppiù, la similitudine fra comportamento animale e umano che vede il microbiota intestinale come elemento di collegamento da interpretarsi nelle logiche della comunicazione intestino-cervello
Il microbioma intestinale può essere utile per diagnosticare comportamenti aggressivi prima della loro manifestazione e potenzialmente discernere eziologie criptiche dell’aggressività (Kirchoff NS, Udell MAR, Sharpton TJ. 2019. The gut microbiome correlates with conspecific aggression in a small population of rescued dogs (Canis familiaris). PeerJ 7: e6103).
Alla luce delle autorevoli evidenze sperimentali si evince l’opportunità di istituire un Osservatorio sul Microbiota animale al fine di raccogliere informazioni e promuovere ricerche sulle interazioni fra Microbiota e organismo animale rispetto ai problemi dell’infiammazione, dell’invecchiamento e del comportamento.
La foto di apertura è di Francesco Caricato
Per commentare gli articoli è necessario essere registrati
Se sei un utente registrato puoi accedere al tuo account cliccando qui
oppure puoi creare un nuovo account cliccando qui


Commenta la notizia
Devi essere connesso per inviare un commento.