Perché i batteri non vogliono gli acidi grassi polinsaturi
Una notizia molto intrigante, con una domanda che sorge spontanea: perché nelle membrane dei batteri non c’è acido linoleico? Qualcuno se lo è mai chiesto? Da quanto emerge, si impone ancora una volta alla ribalta l’olio da olive, meglio se extra vergine: per nutrire in modo adeguato anche i batteri, tanto preziosi per la salute dell’intestino e dell’organismo intero, è fondamentale l’olio giusto
Nel 1929 Burr e Burr scoprirono le caratteristiche di due acidi grassi essenziali: l’acido linoleico (C18:2 n6-LA) e l’acido α-linolenico [C18:3 n3-α LA] (Burr & Burr, 1929). Questi acidi appartengono, rispettivamente, alla serie di acidi grassi n-6 e n-3, vale a dire, hanno un doppio legame carbonio-carbonio finale nella posizione n-6 e n-3, quando si contano dal metile CH3.
Per la nutrizione, il concetto di essenzialità si riferisce a una sostanza nutritiva che non può essere sintetizzata da un organismo e quindi è necessaria la sua assunzione attraverso il cibo. L’acido linoleico (LA), in particolare, può essere considerato uno dei principali legami tra uomo e animale, ambiente e vita. Una totale mancanza dei due acidi grassi sopra menzionati porta a gravi fenomeni patologici progressivi che colpiscono gli organi e i sistemi, fino alla morte.
Negli organismi animali, questi due acidi grassi hanno una complessa attività metabolica che, attraverso l’azione di desaturasi ed elongasi, produce acido arachidonico (C20: 4, ω-6) dall’acido linoleico e acido eicosapentaenoico (C20: 5, ω- 3 [EPA]) e acido docosaesaenoico (C22: 6, ω-3 [DHA]) dall’acido α-linolenico, rispettivamente, senza alcuna possibilità di interscambio tra le vie metaboliche ω-6 e ω-3.
L’acido arachidonico e il DHA sono essenziali per la crescita e la maturazione chimica del cervello durante lo sviluppo fetale e neonatale di tutti gli animali, compresi gli umani (Hornstra, G., Al, M.D., van Houwelingen, A.C., & Foreman-van Drongelen, M.M. (1995). Essential Fatty Acids in Pregnancy and Early Human Development. Eur. J. Obstet. Gynecol. Reprod. Biol., 61: 57-62;Uauy, R.D., Birch, D.G., Birch, E.E., Tyson, J.E., & Hoffman, D.R. (1990). Effect of Dietary Omega-3 Fatty Acids on Retinal Function of Very Low Birth Weight Neonates. Pediatr. Res., 28: 485-492; Neuringer, M., Connor, W.E., Lin, D.S., Barstad, L., & Luck, S. (1986). Biochemical and Functional Effects of Prenatal and Postnatal Omega 3 Fatty Acid Deficiency on Retina and Brain in Rhesus Monkeys. Proc. Natl. Acad. Sci., USA, 83(11):4021-4025; Cocchi, M., & Noble, R. (1992). Il Ruolo del DHA nello Sviluppo Embrionale. Nutrizione, 5: 23- 26; Cocchi, M., Noble, R., Fallowfield, H., Speake, B., & Turchetto, E. (1993). The Significance of n3 Fatty Acids in Foetal Neonatal Development and some Alternative Sources. Proceedings of the Nutrition Society, 52: 224; Noble, R.C. & Cocchi, M. (1990). Lipid Metabolism and the Neonatal Chicken. Prog. Lipid Res. 29:107-140)e sono strettamente legati all’evoluzione (Crawford, M.A. (2006). Docosahexaenoic Acid in Neural Signaling Systems. Nutrition and Health, 18: 263-276; Crawford, M.A. (2010). The Language of Lipids. In S.C. Cunnane and. K.M. Stewart (Eds.), Human Brain Evolution, The Influence of Freshwater and Marine Food Resources (pp.13- 28). New Jersey: Wiley-Blackwell; Crawford, M.A., Broadhurst, L.C., Guest, M., Nagar, A., Wang, Y., Ghebremeskel, K., & Schmidt, W.F. (2012). A Quantum Theory for the Irreplaceable Role of Docosahexaenoic Acid in Neural Cell Signalling Throughout Evolution. Prostaglandins Leukot. Essent. Fatty Acids, pii: S0952- 3278(12)00147-0; Venturi, S., & Venturi, M. (2014). Iodine, PUFAs and Iodolipids in Health and Diseases: An Evolutionary Perspective.Human Evolution, 29 (1-3) :185-205, Special Issue, Part 2). L’acido linoleico e l’acido α-linolenico sono distribuiti nelle membrane cellulari dell’intero organismo, in concentrazioni variabili. Quest’ultimo aspetto si applica principalmente all’acido linoleico, mentre l’acido α-linolenico si trova in tutti i distretti biologici a concentrazioni molto basse e costanti (Abbott, S.K., Elsea, P.L., Atkins, T.A., & Hulberta, A.J. (2012). Fatty Acid Composition of Membrane Bilayers: Importance of Diet Polyunsaturated Fat Balance. Biochimica et Biophysica Acta (BBA) – Biomembranes, 1818: 1309-1317).
Negli organismi animali il C18: 2 svolge un ruolo chiave nella membrana cellulare. Può regolare l’osmosi della cellula, come si verifica nell’epidermide (Hansen, H.S., & Jensen, B. (1985). Essential Function of Linoleic Acid Esterified in Acylglucosylceramide and Acylceramide in Maintaining the Epidermal Water Permeability Barrier. Evidence from Feeding Studies with Oleate, Linoleate, Arachidonate, Columbinate and α-Linolenate. Biochim. Biophys. Acta, 834:357-63) e ha una stretta relazione con colesterolo e ossigeno (Cocchi, M. Minuto, C. Linoleic Acid: A Milestone in Brain Evolution? HUMAN EVOLUTION. Vol. 30 n.3-4 (245-257) – 2015).
A livello cellulare, infatti, l’acido linoleico influenza le pompe e i canali ionici di membrana. È stato anche dimostrato che l’acido linoleico si lega al canale ionico e aumenta la concentrazione di calcio all’interno della cellula (Gilbertson, T.A., Fontenot, D.T., Liu, L., Zhang, H., & Monroe, WT. (1997). Fatty Acid Modulation of K+ Channels in Taste Receptor Cells: Gustatory Cues for Dietary Fat. Am. J. Physiol., 272: 41-4) come si verifica nei recettori del gusto, che si attivano più rapidamente in presenza di acido linoleico nella dieta (Kawa,I, T., & Fushiki, T. (2003). Importance of Lipolysis in Oral Cavity for Orosensory Detection of Fat. Am. J. Physiol., 285:R447-R454)o nelle cellule beta del pancreas (Zhao, Y., Wang, L., Qiu, J., Zha, D., Sun, Q., & Chen, C. (2013). Linoleic Acid Stimulates [Ca2+]i Increase in Rat Pancreatic Beta-Cells through Both Membrane Receptor- and Intracellular Metabolite- Mediated Pathways. PLoS One, 8:e60255).
L’acido linoleico è coinvolto nella regolazione della temperatura corporea. Tende ad aumentare negli animali che vanno in letargo in modo naturale, influenzando l’ingresso del calcio nei cardiomiociti (Carneheim, C., Cannon, B., & Nedergaard, J. (1989). Rare Fatty Acids in Brown Fat are Substrates for Thermogenesis during Arousal from Hibernation. Am. J. Physiol., 256: R146-R154; Giroud, S., Frare, C., Strijkstra, A., Boerema, A., Arnold, W., & Ruf, T. (2013). Membrane Phospholipid Fatty Acid Composition Regulates Cardiac SERCA Activity in a Hibernator, the Syrian Hamster (Mesocricetus auratus). PLoS One, 8:e63111), e i suoi livelli di concentrazione variano a seconda della temperatura, anche negli insetti come come la Drosophila (Parnas, M., Peters, M., & Minke, B. (2009).Linoleic Acid Inhibits TRP Channels with Intrinsic Voltage Sensitivity: Implications on the Mechanism of Linoleic Acid Action. Channels, 3:164-6). Negli animali soggetti a significativi sbalzi di temperatura e che vivono in condizioni estreme come il deserto o l’oceano, ad esempio l’iguana del deserto e la tartaruga marina, l’acido linoleico si trova in concentrazioni maggiori rispetto ad altri animali terrestri (Lawniczak, C.J., & Teece, M.A. (2009). Lipid Metabolism during Embryonic Development of the Common Snapping Turtle, Chelydra serpentina. Comp. Biochem. Physiol. B. Biochem. Mol. Biol., 153:73-80; Simandle, E.T., Espinoza, R.E., Nussear, K.E., & Tracy, C.R. (2001). Lizards, Lipids, and Dietary Links to Animal Function. Physiol. Biochem. Zool., 74:625-40), in particolare nel cervello.
La natura essenziale dell’acido linoleico significa che non solo deve essere introdotto nella dieta, ma le sue diverse concentrazioni in diverse parti dell’organismo mostrano che è sottoposto a un’incorporazione selettiva in modo da essere presente in concentrazioni ottimali nei diversi distretti biologici. Ad esempio, il cervello, a differenza della cellula cardiaca che ne contiene elevate quantità, ha concentrazioni estremamente basse di acido linoleico, che tendono ad avvicinarsi allo zero in quasi tutte le specie animali sulla terra: nell’uomo (Svennerholm, L. (1968). Distribution and Fatty Acid Composition of Phosphoglycerides in Normal Human Brain. J. Lipid Res., 9: 570-579), nei serpenti (Speake et al., 2003a) e negli uccelli come oche, anatre e pinguini (Speake, B.K., Thompson, M.B., Thacker, F.E., & Bedford, G.S. (2003). Distribution of Lipids fromThe Yolk to the Tissues during Development of the Water Python (Liasis fuscus). J. Comp. Physiol. B., 173:541-547; Speake, B.K., Decrock, F., Surai, P.F., Wood, N.A.R., & Groscolas, R. (2003b). Establishment of the Fatty Acid Profile of the Brain of the King Penguin (Aptenodytes patagonicus) at Hatch: Effects of a Yolk that is Naturally Rich in n-3 Polyunsaturates. Physiol. Biochem. Zool., 76:187-195). Recentemente sono state osservate concentrazioni molto basse di acido linoleico nelle piastrine sia nei disturbi dell’umore sia nelle cardiopatia ischemica (Cocchi, M., Tonello, L., Bosi, S., Cremonesi, A., Castriota, F., & Puri, BTS. (2004). Platelet Oleic Acid as Ischemic Cardiovascular Disease Marker. BMJ., 329:1447; Cocchi, M., & Tonello, L. (2010). Bio Molecular Considerations in Major Depression and Ischemic Cardiovascular Disease. Central Nervous System Agents in Medicinal Chemistry, 9: 2-11; Cocchi, M., Gabrielli, F., & Tonello, L. (2013). Platelet’s Fatty Acids Secrets in Coronary Artery Disease (CAD). Lett to Ed. BMJ., Oct 28th; Benedetti, S., Bucciarelli, S., Canestrari, F., Catalani, S., Mandolini, S., Marconi, V., et al. (2014). Platelet’s Fatty Acids and Differential Diagnosis of Major Depression and Bipolar Disorder through the Use of an Unsupervised Competitive-Learning Network Algorithm (SOM). Open J. Depress., 3:52-73; Cocchi, M., Tonello, L., Gabrielli, F., Minuto, C., & Tuszynski, J. (2015). Connection Between the Linoleic Acid and Psychopathology: A Symmetry-Breaking Phenomenon in the Brain? Commun. to Ital. Soc. Exp. Biol. (Bologna Section) April).
La membrana cellulare, con il suo doppio strato di fosfolipidi e gli acidi grassi che ne caratterizzano la composizione, rappresenta l’unità biologica che determina il corretto funzionamento di tutti gli organismi viventi, dai batteri agli umani. In particolare, la composizione di acidi grassi della membrana, che regola la mobilità (viscosità e fluidità), ne consente l’adattamento alle caratteristiche ambientali. Questo avviene attraverso complesse attività enzimatiche che lavorano metabolicamente sull’allungamento e la desaturazione degli acidi grassi, consentendo l’adeguamento di scambi intra-extra cellulari.
La gascromatografia degli acidi grassi della membrana batterica presenta complessità metodologica per quanto riguarda l’estrazione, la preparazione e l’identificazione degli acidi grassi.
Per questo motivo, è stata seguita da altre tecniche che consentono l’identificazione degli acidi grassi: spettrometria di massa e cromatografia su strato sottile.
I risultati ottenuti hanno dimostrato l’assenza di acido linoleico nelle membrane dei batteri studiati. Tuttavia, la presenza di particolari acidi grassi, comunemente noti come acido linoleico coniugato (CLA), normalmente ottenuto dal metabolismo dell’acido linoleico, ci ha convinto che – data l’assenza assoluta di acido linoleico, avrebbero potuto derivare solo dall’isomero trans di Acido Oleico (vedi tabella 1).
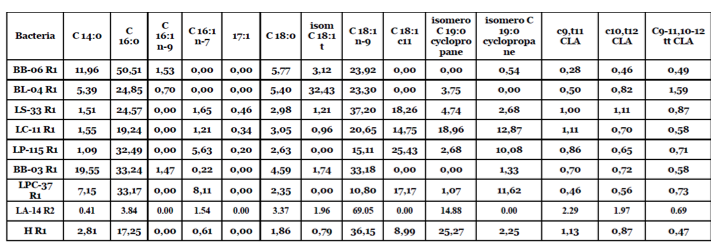
Tabella 1. Profilo degli acidi grassi di alcuni ceppi batterici (lattobacilli e batteri bifidi). Si noti l’assenza di C18: 2 ω-6 [LA]. Altre scoperte in letteratura confermano l’assenza di acido linoleico nelle membrane dei ceppi di lattobacilli, dove è presente solo se aggiunto al terreno di coltura (Kankaanpa, P., Yang, B., Kallio, H., Isolauri, E., & Salminen, S. (2004). Effects of Polyunsaturated Fatty Acids in Growth Medium on Lipid Composition and on Physicochemical Surface Properties of Lactobacilli. Applied and Environmental Microbiology, 70: 129-136).
In questi organismi, quindi, l’acido linoleico non può avere caratteristiche di essenzialità.
Una domanda sorge spontanea: perché nelle membrane dei batteri non c’è Acido Linoleico?
La membrana cellulare vive una condizione costante di mobilità e, quando le oscillazioni degli acidi grassi attraversano il range di tolleranza della stessa, possono essere espressi fenomeni patologici.
La struttura dell’acido linoleico indica che l’allargamento dei foglietti fosfolipidici della membrana cellulare, in cui può essere inserito, causerà più facilmente un rilassamento della membrana stessa, aumentandone la fluidità e, di conseguenza, modificandone la funzionalità e le condizioni chimico-fisiche.
In definitiva l’Acido Linoleico condiziona la dinamica della membrana. Esso, infatti, è l’acido grasso che, fra tutti gli altri, occupa una dimensione spaziale maggiore e ciò, all’aumentare della concentrazione, determina due fatti fondamentali, accresce la fluidità della membrana e costringe il colesterolo ad aumentare anche la propria concentrazione per mantenere in equilibrio l’assetto fisico chimico della stessa membrana (Cocchi, M. Minuto, C. Linoleic Acid: A Milestone in Brain Evolution? HUMAN EVOLUTION. Vol. 30 n.3-4 (245-257) – 2015).
Torniamo ai batteri.
Come si spiega che i batteri essi sono privi di Acido Linoleico?
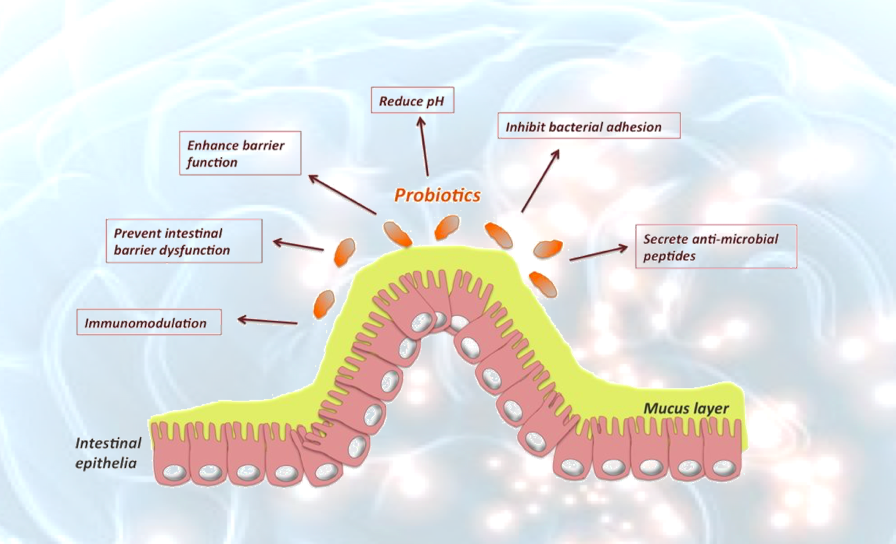
La risposta viene da autorevoli lavori della letteratura che suggeriscono come esso sia responsabile di un fenomeno che impedisce al batterio di utilizzare le “adesine” per incollarsi alla parete intestinale e, di fatto, renderla più vulnerabile all’apertura delle giunzioni serrate e, di fatto, favorire il passaggio delle sostanze pro infiammatorie.
Arif Ismaili et al. (ARIF ISMAILI et al. Modulation of host cell membrane fluidity: a novel mechanism for preventing bacterial adhesion. 1999 the American Physiological Society) provano che il legame dei batteri patogeni potrebbe essere influenzato dai cambiamenti nella fluidità della membrana plasmatica delle cellule ospiti. I risultati dello studio forniscono la prova che l’adesione batterica alle cellule ospiti in vitro può essere prevenuta aumentando la fluidità della membrana delle cellule bersaglio con agenti che mobilitano la membrana plasmatica.
È possibile che gli studi in vitro possano aiutare a preparare il terreno per determinare il ruolo dell’alterata fluidità della membrana nell’inibire l’adesione batterica in vivo. Diversi studi, comunque, hanno dimostrato che l’alimentazione di animali arricchita con grassi insaturi può modulare la composizione degli acidi grassi e la fluidità delle membrane plasmatiche (McMurchie, E. J. Dietary lipids and the regulation of membrane fluidity and function. In: Physiological Regulation of Membrane Fluidity, edited by R. C. Aloia, C. C. Curtain, and L. M. Gordon. New York: A. R. Liss, 1988. p. 189–237).
La costituzione della microflora intestinale e dei batteri probiotici può controllare le condizioni infiammatorie nell’intestino. Poiché gli acidi grassi polinsaturi (PUFA-acidi grassi polinsaturi) possiedono attività antimicrobiche, possono scoraggiare l’azione dei probiotici. E’ stato valutato se gli acidi linoleico libero, γ-linolenico, arachidonico, α-linolenico e docosaesaenoico (DHA) a concentrazioni fisiologiche nei terreni di crescita influenzano la crescita e l’adesione alla mucosa di alcune specie di lattobacilli.
Livelli rilevanti di PUFA liberi possono influenzare le funzioni dei probiotici. Di conseguenza, i probiotici senza adesività, possono essere “eliminati” dal tratto gastrointestinale e i potenziali benefici per la salute possono essere compromessi.
Pertanto, una migliore comprensione delle interazioni tra fattori dietetici, come i PUFA e la microflora intestinale è un prerequisito, quando gli effetti benefici di nuovi alimenti funzionali contenenti probiotici sono progettati e valutati clinicamente.
Poiché l’adesione alle superficie della mucosa è fondamentale negli effetti di promozione della salute da parte dei probiotici, i risultati delle ricerche indicano che l’azione dei probiotici nell’intestino può essere anche negativamente modulata dai PUFA dietetici.
In conclusione si dovrebbe prestare attenzione alla eccessiva presenza dei PUFA in generale, in particolare dell’Acido Linoleico, sia nei mezzi di coltura dei vari ceppi batterici sia nell’alimentazione quotidiana ricca di PUFA e, nella fattispecie di Acido Linoleico, come oli di semi, lecitine ecc. (Pasi E. Kankaanpaa et al. The influence of polyunsaturated fatty acids on probiotic growth and adhesion. FEMS Microbiology Letters 194 (2001) 149^153).
Ancora una volta sale alla ribalta l’olio di oliva, meglio se extravergine, per nutrire in modo adeguato anche i batteri, tanto preziosi per la salute dell’intestino e dell’organismo intero.
L’acido linoleico, nelle quantità adeguate, consente la vita ai mammiferi e, quando non c’è, garantisce la vita ai batteri intestinali e all’Ape Regina (Cocchi et al. Progress in Nutrition, in corso di stampa).
Per commentare gli articoli è necessario essere registrati
Se sei un utente registrato puoi accedere al tuo account cliccando qui
oppure puoi creare un nuovo account cliccando qui


Commenta la notizia
Devi essere connesso per inviare un commento.